Das Geheimnis des Wassers
Wasser als MaterieWasser ist H2O. Das ist doch ganz klar, das haben wir doch in der Schule gelernt, im Chemieunterricht, und im Physikunterricht haben wir dann noch einiges über Wasserkraft dazugelernt.
Aber ist das schon alles? Ist Wasser nur ein Stoff, der sich in einer chemischen Formel ausdrücken läßt, ausgestattet mit chemischen und physikalischen Eigenschaften, die nur im materiellen Bereich liegen, ein Stoff, der allenfalls noch mit gewissen energetischen Eigenschaften versehen ist?
Wer sich näher mit dem Element Wasser befaßt, wird staunen, welch ein Wunderwerk dieses Wasser ist, wie geheimnisvoll und unbekannt es uns im Grunde immer noch ist, trotz aller Informationen, die wir täglich erhalten.Wasser ist weit mehr als »nur« Materie,
- es ist Energie und Energieträger
- es ist ein Informationsträger
Wasser durchzieht alle Dimensionen des Lebens, es ist die Grundlage allen Lebens. Es ist ein äußerst vielseitiges Medium, und ohne diese Vielseitigkeit wären die vielfältigen Funktionen, die das Wasser in der Natur und im Menschen ausübt, nicht möglich.
Wasser als Materie
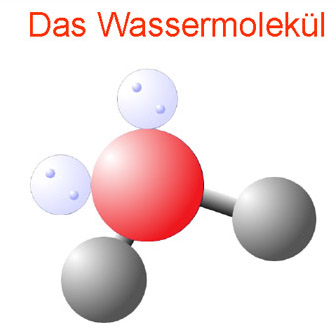
Wasser ist natürlich zunächst einmal wirklich das, was wir mit der chemischen Formel H2O bezeichnen. Es ist eine chemische Verbindung der Gase Wasserstoff, griech. Hydrogenium, und Sauerstoff, griech. Oxygenium. In einer chemischen Bindung eines Sauerstoffatoms mit zwei Wasserstoffatomen bildet sich ein winziges Molekül, das Wassermolekül.
Dieses Wassermolekül ist ein wahrer Winzling, etwa ein Zehnmillonstel Millimeter klein. 10 Milliarden von diesen Winzlingen passen in einen Stecknadelkopf. Können Sie sich vorstellen, wie viele dieser Moleküle nötig sind, um eine Talsperre zu füllen?
Aber so winzig die Wassermoleküle auch sind, sie sind überall zu finden: Sie verbinden sich zu einem Netz von Flüssigkeit, das alle Materie durch-zieht, in mehr oder weniger ausgeprägter Form, das wie ein Raster unseren Planeten durchzieht, von der saftigen Wassermelone bis hin zum von der Sonne ausgedörrten Felsen. Wasser durchzieht alle Materie und ist selbst Materie.
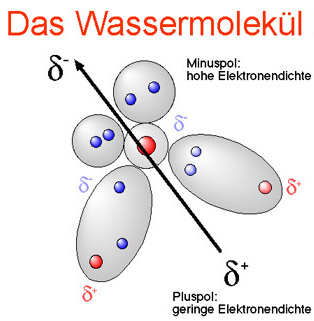
Bei einer Molekülbildung bildet aufgrund der elektrischen Ladungen der beteiligten Atome das Sauerstoffatom mit den beiden Wasserstoffatomen einen V-förmigen Winkel von 104,5 Grad. Die elektrischen Ladungen sind auch für den entscheidenden Dipolcharakter des Wassermoleküls verantwortlich: Das Sauerstoffatom an der Spitze des V-Winkels hat eine schwach negative Ladung (Minuspol des Moleküls), die zwei Wasserstoffatome schwach positive Ladungen (Pluspole des Moleküls).
Durch diese Dipolanordnung erhält das Wassermolekül seine typischen Eigenschaften: Bei der Elektrolyse wird Wasser in seine Bestandteile zerlegt, indem es an der Kathode (Minuspol) Wasserstoff und an der Anode (Pluspol) Sauerstoff im Verhältnis 2:1 abscheidet. Entsprechend hat der Wasserstoffpol des Wassermoleküls eine Affinität zu Anionen, der Sauerstoffpol zu Kationen. Außerdem wirken diese positiven und negativen Ladungen der Atome durch ihre Anziehungskräfte auf andere H2O-Moleküle, so daß sich mehrere Wassermoleküle über Wasserstoffbrücken
aneinander binden und somit, wie Wissenschaftler annehmen, dreidimensionale Netzwerke unterschiedlicher Größe, sogenannte Cluster (= Molekülhaufen), bilden können.
Die besondere Struktur der Wassermoleküle und ihre durch die Wasserstoffbrücken erreichten Clusterbildungen sind offensichtlich der Schlüssel für die typischen Verhaltensweisen des Wassers.
Es scheint so, als wäre die Clusterbildung eine neue Aggregatform neben fest, flüssig, gasförmig, kristallin und kolloidal. Denn Cluster unterscheiden sich durch ihre Entstehung von anderen Aggregatzuständen: An ein einzelnes Molekül lagern sich nacheinander weitere an, jedoch nicht nach üblichem Kristallbaumuster, sondern die Cluster ordnen sich während des Wachstumsprozesses ständig, z. B. spiralförmig, um. Am Ende des Bildungsprozesses kommen dann die Cluster der Kristall Struktur nahe. Nach dem Übergang in die Kristallstruktur ist die Clusterbildung abgeschlossen, es findet keine Umstrukturierung mehr statt. Damit hat das Cluster seinen endgültigen Energie- und Informationsgehalt erhalten.
Diese ganzen Strukturbildungen sind zwar für die Qualität und Funktionen des Wassers immens wichtig, aber noch wenig erforscht. Gesichert scheint zu sein, daß Wasser ein sogenanntes Zwei-Phasen-System bildet: Es besitzt einen Anteil ungeordneter Wassermoleküle (die sogenannte normal-flüssige Phase) und gleichzeitig einen anderen Anteil geordneter Wassermoleküle (die sogenannte kristallin-flüssige Phase). Die energetischen Bindungen in der normal-flüssigen Phase sind sehr gering, während die energetischen Bindungen in der kristallin-flüssigen Phase, deren Struktur einen gleich hohen Ordnungsgrad wie die Kristalle besitzt, sehr hoch sind. Dies besagt, daß Wasser mit Struktur durch die zwischenmolekularen Kräfte eine hohe Bindungsenergie hat. Sie führt zur Bildung von Wasserstoffbrücken, die die Voraussetzung für die Strukturbildung sind, und zur Verbindung mehrerer hundert Wassermoleküle.Die Clusterstruktur ist sehr labil, ihre Bildung und Lösung hängt sehr stark von der Temperatur oder anderen Energieanreicherungen der Wassermoleküle ab. Temperaturänderungen bewirken Umbildungen der Wasserstrukturen und damit Wechsel zwischen den Aggregatzuständen
- »fest« = Eis
- »flüssig« = Wasser
- »gasförmig« = Dampf und
- »kolloidal«.
Tatsächlich finden sich im flüssigen Wasser sowohl in Clustern gebundene Wassermoleküle als auch freie (monomere) Wassermoleküle. Die Bindungen sind jedoch nicht statisch, sondern die Cluster lösen sich immer wieder auf und binden sich immer wieder neu. So sind die Wassermoleküle mal ungebunden, mal gebunden.
Die Clusterstruktur ist der Schlüssel zum Verhalten des Wassers; die Cluster speichern Energien und Informationen und somit wird das Wasser ein Energie- und Informationsträger ersten Ranges. Und nur deshalb ist es »lebendig« oder »tot«, kann es uns krank oder gesund machen.Verantwortlich für unsere Gesundheit oder Krankheit sind also nicht allein die chemischen Inhaltsstoffe als solche, die eine Reihe lokaler chemischer Prozesse auslösen oder die im Körper abgelagert werden und damit bestimmte Funktionen blockieren können, sondern mitverantwortlich sind die Frequenzen und Informationen dieser Inhaltsstoffe, die sich auf das Wasser übertragen und die von dort aus das Regulationsgeschehen des Körpers beeinflussen. Diese äußerst wichtige Erkenntnis wird uns immer wieder beschäftigen.
Die Wassermoleküle haben nun ganz ungewöhnliche Eigenschaften, die alle Gesetze der Chemie und Physik auf den Kopf stellen, und die gerade deshalb erst das Leben auf diesem Planeten ermöglichen.
Durch die erwähnte unterschiedliche elektrische Ladung von Sauerstoff und Wasserstoff ergibt sich eine Polarisierung des H2O-Moleküls, also ein elektrischer Dipol mit Plusladung und Minusladung, charakterisiert durch die Polarität von Form (der Struktur des Wassers) und Inhalt (der Energie und der Information). Beide zusammen - Form und Inhalt - verleihen dem Wasser jene Eigenschaften, die es nach den Gesetzen von Chemie und Physik gar nicht haben dürfte, die aber, wie oben schon gesagt, die Voraussetzungen für das Leben auf unserem Planeten sind.Das Wichtigste: Wasser dürfte gar nicht flüssig sein. Weil seine Ausgangs-elemente Gase sind, müßte Wasser gasförmig sein. Das ist es aber bekanntlich nur bei Temperaturen über 100 Grad C.
Wasser gefriert bzw. schmilzt bei 0 Grad C und siedet bzw. verdampft bei + 100 Grad C. Das ist für uns normal. Aber diese »Normalität« beruht zunächst einmal darauf, daß Schmelzpunkt und Siedepunkt zwei Hauptwerte der Celsius-Thermometerskala sind, die nach dem Verhalten des Wassers festgelegt wurden.
Wasser müßte bei 0 Grad C eigentlich ein Gas sein. Statt dessen gefriert es bei 0 Grad C - oder taut, je nachdem, welchen Standpunkt man hat. Dabei hat es mit 0 Grad C einen - gemessen an anderen Stoffen - anormal hohen Gefrierpunkt. Normal wäre nach den Gesetzen der Chemie bzw. des Periodensystems der Elemente ein Gefrierpunkt von etwa -120 Grad C. Übrigens gefriert Meerwasser, das gelöste Salze enthält, erst bei -2,2 Grad C. Je dichter die wäßrige Lösung ist, desto niedriger kann die Temperatur sein, ohne daß die Lösung gefriert. Einige Fische in der Antarktis haben glyzerinähnliche Partikel im Blut, die sie in Meerwasser- und bei Körpertemperaturen von -4 Grad C überleben lassen.
Wasser hat mit +100 Grad C einen - gemessen an anderen Stoffen - anormal hohen Siedepunkt. Aufgrund seines Molekulargewichts müßte er eigentlich bei -75 Grad C liegen. Flüssiges Wasser gäbe es dann nur an den Polen und auch nur an den kältesten Tagen. Wissenschaftler gehen davon aus, daß der anormal hohe Siedepunkt dadurch zustande kommt, daß zum Aufbrechen der Wasserstoffbrücken, Voraussetzung für das Sieden, eine höhere Wärmeenergiezufuhr nötig ist.Die Differenz zwischen Gefrierpunkt und Siedepunkt des Wassers beträgt bei der Celsiusskala 100 Grad, bei seiner Molekülgröße müßte sie etwa bei 25 bis 30 Grad Celsius liegen.
Die Dichte des Wassers nimmt bei steigender Temperatur im Gegensatz zu anderen Stoffen zunächst zu. Erst bei 4 Grad C hat Wasser seine größte Dichte (genau bei 3,98 Grad C). (Wasser ist also bei 4 Grad C am schwersten.)
1 cm3 destilliertes Wasser wiegt bei 4 Grad C 1 Gramm, bzw. 1 Liter wiegt 1 Kilogramm. Die Dichte von Eis ist also geringer als die Dichte von flüssigem Wasser; Eis hat bei gleichem Gewicht ein um 9 Prozent größeres Volumen als flüssiges Wasser, weil beim Gefrieren vermehrt Kristallstrukturen entstehen, die durch ihre Wasserstoffbrücken Hohlräume bilden. Aus diesem Grund platzen mit Wasser gefüllte Glasflaschen, wenn's friert, und deshalb verliert das Eis beim Schmelzen an Volumen. Diese Vorgänge sind für uns ein Segen. Wäre es nämlich anders, hätte Eis eine größere Dichte als flüssiges Wasser, wäre es also schwerer als flüssiges Wasser, würden die Eisschollen nicht auf dem Wasser schwimmen, sondern sie würden auf den Meeresgrund sinken und dort dicke Eisschichten bilden, die alles Leben im Wasser erstickten. Im tieferen Wasser können sie auch nicht auftauen, weil die Wärme der Sonnenstrahlen bestimmte Tiefen nicht mehr erreicht. Auf dem Grunde tiefer Seen würde sich »ewiges Eis« bilden, und Leben wäre unmöglich. Tatsächlich aber sinkt natürlich das dichteste Wasser -von 4 Grad C - auf den Grund und ermöglicht dort das winterliche Überleben der an diese Temperaturen angepaßten Pflanzen und Tiere. Die oberflächliche Eisschicht schützt das tiefere Wasser vor zu großer Kälte und somit das Leben vor dem Erfrieren. Auch die Bildung der Eiskristalle (wie die Bildung der Kristalle in flüssigem Wasser) wird überwiegend durch den Dipolcharakter der Wassermoleküle und ihre Wasserstoffbrücken bestimmt.
Wasser ist ein guter Wärmespeicher. Denn Wasser nimmt beim Erwärmen viel Energie auf und gibt sie nur langsam wieder ab. Erwärmen bedarf hoher Energie, weil die Wasserstoffbrücken, die die Wassermoleküle bei Normaltemperatur miteinander verbinden, nur durch Wärmeenergie aufgebrochen werden können.Nach den Erkenntnissen der Wissenschaft sind bei 0 Grad C etwa 700 Wassermoleküle über Wasserstoffbrücken zu Clustern vernetzt, bei Zimmertemperatur etwa 400, bei 100 Grad C noch 50, verdüstert, erst bei ca. 400 Grad C sind sämtliche Wasserstoffbrücken aufgebrochen und nur noch Einzelmoleküle vorhanden. Brechen die Cluster nun auf, verliert das Wasser an Energie und Information. Auf diesen Vorgang werden wir noch zurückkommen. Erst nach dem Aufbrechen der Wasserstoffbrücken kann die Wärme in freie Beweglichkeit der Moleküle umgesetzt werden und sich das Wasser durch Bewegung ausdehnen. Deshalb bleibt Wasser so ungewöhnlich lange flüssig - volle 100 Celsiusgrade lang - bevor es in den gasförmigen Dampfzustand übertritt. Diese Wärmeenergie wird nun im Wasser gespeichert und beim Abkühlen nur langsam abgegeben. In der Natur kommt es zu mehreren Folgen, die wiederum Voraussetzungen für unser Leben sind:
- Die gewaltigen Wassermengen der Weltmeere wirken wie eine gigantische Klimaanlage, die die jahreszeitlichen Temperatur-schwankungen unserer Erde durch Wärmeaufnahme und Wärmeabgabe ausgleicht; die großen marinen Wärmeströme der Erde erwärmen die umliegenden Regionen, wie der Golfstrom die arktischen Gebiete bis nach Norwegen hinauf. Folge für die Technik ist: Wasser kann Dampfturbinen und Dampfmaschinen antreiben, weil es sich beim Verdampfen auf das 1600fache ausdehnen kann. Die beim Abkühlen abgegebene Wärmeenergie kann in andere Energieformen umgewandelt und somit genutzt werden.
- Wasser kann in engen Röhren, wie Pflanzen- oder Baumadern, die Erdgravitation überwinden. Zwischen den Molekülen des Wassers und höhergelegenen Sauerstoff- und Stickstoffatomen der Gefäßwand bilden sich Wasserstoffbrücken, die Gefäßwand und Wasser chemisch verbinden. Mit der Wasseroberflächenspannung »zieht« sich das Wasser auf das Niveau der oberen Gefäßwand-Sauerstoffatome bzw. -Stickstoffatome hoch und nimmt dabei über Wasserstoffbrücken das darunterliegende Wasser mit hoch. Anschließend bilden sich neue Wasserstoffbrücken mit höherliegen-den Gefäßwandatomen, die Oberflächenspannung zieht das Wasser wieder hoch und so weiter. Auf diese Weise kann Wasser gegen die Schwerkraft bis in die Wipfel hoher Bäume »klettern«.
Eine andere Form der Überwindung der Schwerkraft erzielt Wasser in kolloidalen Lösungen, wie in Zellen und Blutadern. Die Kolloide zeichnen sich dadurch aus, daß die in ihnen gebundenen Partikel nicht dem Gesetz der Schwerkraft entsprechend nach unten sinken, sondern in der Schwebe bleiben. Auf dieses für die Zellfunktionen lebensnotwendige Phänomen werden wir später zurückkommen.
Wir erkennen: Wenn sich die Wassermoleküle so verhalten würden, wie sie es eigentlich nach den Gesetzen der Chemie müßten, dann würde unsere Welt anders aussehen. Aber warum verhält sich das Wasser nun so und nicht anders? Kann es ein Zufall sein, wenn sich Wasser als Grundlage des Lebens auf diesem Planeten so anders verhält als es sich eigentlich verhalten müßte? Ist es angesichts dieses geheimnisvollen Wunders vermessen, dahinter einen intelligenten Plan zu vermuten?